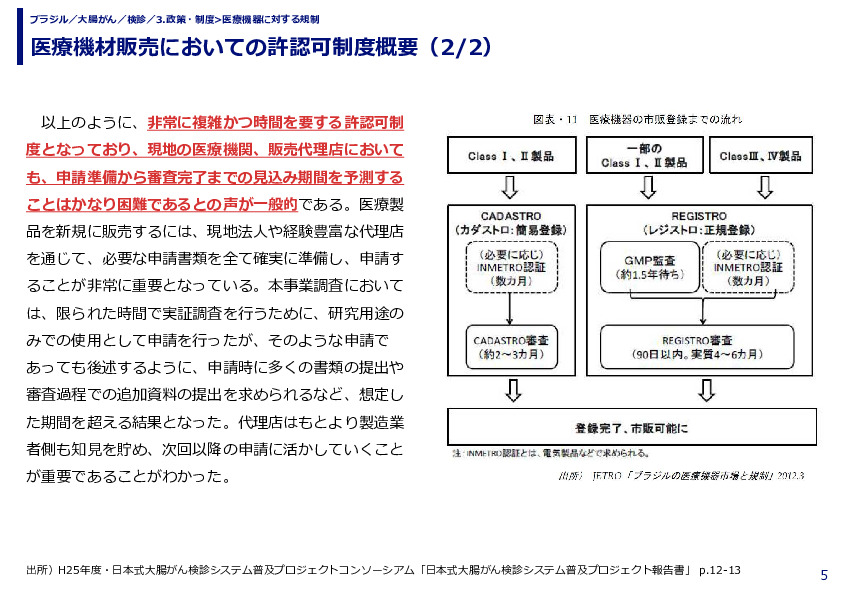
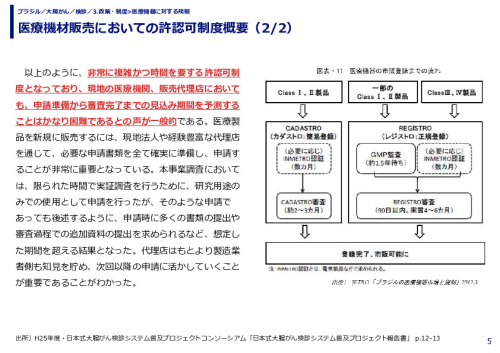
ブラジル市場に出荷される全ての医療機器の許認可、規制関係は、保健省直轄の国家衛生監督庁(Agência Nacional de Vigilância Sanitária;ANVISA)が所管している。許認可、規制の特徴は下記の通りとなる。 ・規制類は特に欧州の体系を参考にして構築されている。 ・ANVISAへの登録手続きには簡易登録と正規登録の二種類あり、低リスク製品は製造工場の品質管理システム監査:GMP(Good Manufacturing Practice)監査が省略され、申請からおよそ6ヶ月で登録完了とされている。一方、高リスク製品はANVISAによるGMP監査が必須となる。ANVISAの人員に限りがあることから、現状では監査待ちの状況となっており、GMP監査を含めて申請から登録完了まで2年以上かかっているのが実態である。 ・GMP監査を一度受けていれば2年間は有効。その後自主監査でさらに2年間は継続が可能となる。 ・ANVISAによる審査が完了し、官報により承認・製品の登録が完了した時点でブラジル全土において当該製品を販売することが可能となる。 ・電気部品を含む医療機器は国立度量衡・工業品質企画院(INMETRO)認証を先に取得する必要あり、その認証取得に数ヶ月がかかる。 ・研究のみに使用される医療機器の登録や製品登録済みの医療機器の外観・包装の変更及び製品登録済みの医療機器のアクセサリーは、簡易・正規登録が免除される。
よくある質問をご覧いただき、ご質問が解決しない場合は、下記お問い合わせフォームよりお問い合わせ下さい。